- HOME
- 基礎・トランスレーショナル研究 心不全
基礎・トランスレーショナル研究
不整脈1│不整脈2│血管炎│心不全│血液凝固│その他│循環生理解析グループ
臨床研究
心不全の分子機序の解明を目指した研究
研究目的
私たちは、心不全の発症メカニズムを探索することにより、新たな心不全治療の標的を見いだそうとして日夜研究を行っております。その結果から得られた知見を臨床にフィードバックして、難治性の病態である心不全の治療に結びつけることを目的としています。
研究内容
1. 心筋細胞のストレスに対する適応・代償機転に関与する分子機序の解明
外的なストレスに対する心筋細胞の適応・代償機構として代表的なものとして心筋細胞の肥大が挙げられます。
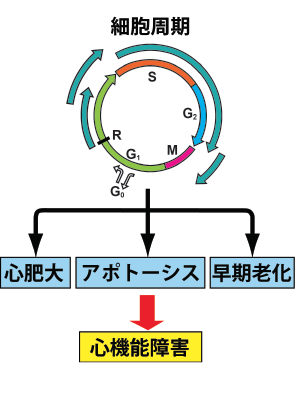
図1:心筋細胞における細胞周期 制御因子の多様な作用
私たちの研究グループの前身である旧第二内科循環器研究室でははやくから心肥大と心不全の関わりについて着目し、心肥大を促進する液性因子としてエンドセリン(Ito H. Circ Res 1991; Ito H. JCI 1993; Ito H. Circulation 1994; Tamamori M. JCI 1996)やインスリン様成長因子(Ito H. Circ Res 1993; Ito H. JCI 1993; Adachi S. JMCC 1994)、心肥大を抑制する液性因子としてナトリウム利尿ペプチド(Adachi S. AJP 1995; Fujisaki H. JCI 1995; Tanaka M. JACC 1995)を見いだし、これらの因子が心肥大の制御にどのようにして関わっているのかというメカニズムを解明してきました。
殊にこれらのメカニズムがアンジオテンシンIIによる心肥大の促進機序に大きく関与していることを明らかにした発見は、現在の抗心不全治療の中心に位置付けられているACE阻害薬やアンジオテンシンII受容体拮抗薬を用いた治療の理論的な根幹となっており、非常に重視されています。さらに心筋細胞肥大をもたらすメカニズムに、細胞周期が関与していることも明らかにしてきました(Tamamori M. AJP 1998; Nozato T. JMCC 2001)(図1)。
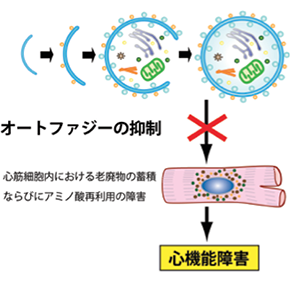
図2:オートファジーと心機能低下の関わり
近年、オートファジーと呼ばれる細胞内分解機構が細胞内の老廃物を浄化することで細胞の恒常性を保ち、神経細胞や心筋細胞のような非分裂細胞においては特にその生命維持に重要な役割を有していることが判ってきました。近年、細胞内タンパク品質管理の異常が心不全の原因になっているのではないかという、いわゆる「心臓におけるAlzheimer病説」が提唱されるようになり、心臓におけるオートファジーの役割がますます注目されています(Willis MS. NEJM 2013)。
提携研究施設であるラトガース・ニュージャージー医科大学細胞生物学教室・心臓血管研究所では心筋細胞におけるオートファジーの役割についての研究が精力的に進められています(Hariharan N, Maejima Y et al. Circ Res 2010: 2010 Annual Best Manuscript Award in Circulation Reseach、他多数)。私たちの研究グループは生物学の中で現在も大きな注目を浴びている分野のひとつであるオートファジーと心不全との関わりについての研究を大きな柱として捉えており、まだ未知の部分が多いオートファジーのメカニズムを解明していくことを目指しています(Maejima Y. Nat Med 2013)(図2)。
2. 心筋細胞死に関与する分子機序の解明
持続的かつ過度なストレスを受けた心筋細胞の代償機構はやがて破綻し、心機能低下に陥り、心不全を発症します。このプロセスにおける重要な因子は個々の心筋細胞の収縮力低下や、心筋細胞死による心筋細胞の脱落ならびに線維化など間質の変化であると考えられています。心筋細胞死には壊死・アポトーシスなどいくつかのタイプがありますが、旧第二内科循環器研究室は世界ではじめて心不全の病態に心筋細胞のアポトーシスが関与していることを報告しました(Tanaka M. Circ Res 1994)。
さらに、分裂細胞では細胞の増殖、心筋細胞では心肥大に重要な役割を担っている細胞周期が心筋細胞のアポトースに大きく関与していることも証明してきました(Adachi S. Circ Res 2001; Maejima Y. Cardiovasc Res 2003)(図1)。さらに、私たちは一酸化窒素(NO)が細胞周期の制御やS-nitrosylation(システイン残基の-SHを-SNOに修飾し、蛋白の機能を制御すること)によるcaspase-3活性の抑制を介して心筋細胞のアポトーシスを阻害していることを立証しました(Maejima Y. JMCC 2005)。
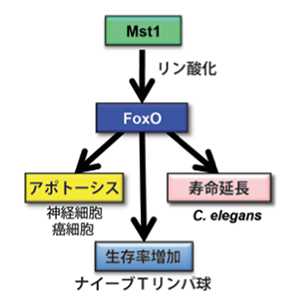
図3:Mst1によりリン酸化を受けたFoxO1は多様な作用を示す
フォークヘッド型転写因子のひとつであるFoxO1における転写後調節が心筋細胞の生死にいかなる役割を果たしているのかについても私たちの研究グループの主要なプロジェクトのひとつです。FoxO1はアポトーシスを促進する作用がある一方で、抗酸化作用やDNA修復を促進する作用も有するなど細胞の生死を二面的に制御しているユニークな転写因子です(図3)。その多様性はFoxO1を上流で制御しているキナーゼや脱アセチル化酵素などによる転写後調節の多様性に依存していると考えられています。前者の代表例としてAkt, Mst1, cdk2などがあり、後者の代表例として長寿因子としても注目されているSirt1があります。私たちは主にMst1などのキナーゼが心不全の病態においてFoxO1の作用をどのようにして制御しているのかについて研究を進めております(Maejima Y. AHA Marcus Award 2012)(図3)。
・主な業績(代表6編)
Maejima Y, Kyoi S, Zhai P, Liu T, Li H, Ivessa A, Sciarretta S, Del Re DP, Zablocki D, Hsu CP, Lim DS, Isobe M, Sadoshima J. Mst1 inhibits autophagy by promoting the interaction between Beclin1 and Bcl-2. Nat Med 19: 1478-1488, 2013.
Usui S*, Maejima Y*, Pain J, Hong C, Cho J, Park JY, Zablocki D, Tian B, Glass DJ, Sadoshima J. Endogenous muscle atrophy F-box mediates pressure overload-induced cardiac hypertrophy through regulation of NF-kB. Circ Res 109: 161-171, 2011. *Equally contribution.
Maejima Y, Usui S, Zhai P, Takamura M, Kaneko S, Zablocki D, Yokota M, Isobe M, Sadoshima J. MuRF1 negatively regulates pathological cardiac hypertrophy through downregulation of calcineurin A. Circ Heart Fail 7: 479-490, 2014.
Maejima Y, Adachi S, Ito H, Isobe M. Induction of premature senescence in cardiomyocytes by oxidative stress as a novel mechanism of myocardial dysfunction. Aging Cell 7:125-136, 2008.
Maejima Y, Adachi S, Ito H, Nobori K, Tamamori-Adachi M, Isobe M. Nitric oxide inhibits ischemia/reperfusion-induced myocardial apoptosis by modulating cyclin A-associated kinase activity. Cardiovasc Res 59:308-320, 2003.
Maejima Y, Adachi S, Morikawa K, Ito H, Isobe M. Nitric oxide inhibits myocardial apoptosis by preventing caspase-3 activity via S-nitrosylation. J Mol Cell Cardiol 38:163-174, 2005.
さらに、私たちは心筋細胞において早期老化が起こり、心筋障害の機序の一つになっていることも明らかにしています。細胞の老化が酸化ストレス等により短期間のうちに誘導される現象は早期老化と呼ばれます。私たちは心筋細胞においても細胞周期の抑制が起こることで早期老化が誘導され、心筋障害の一因となっている可能性を示しました(Maejima Y. Aging Cell 2008)(図1)。
私たちの研究グループは研究成果で得られた知見を効果的でかつ副作用の少ない心不全治療薬の開発に結びつけることを目指しています。このため、市販されている薬剤のもつ新規の抗心不全作用を発見する研究にも積極的に取り組んでいます(Maejima Y. Lab invest 2011)。
文:前嶋康浩






