- HOME
- 基礎・トランスレーショナル研究 不整脈2
基礎・トランスレーショナル研究
不整脈1│不整脈2│血管炎│心不全│血液凝固│その他│循環生理解析グループ
臨床研究
細胞外核酸・小胞を介した、不整脈における心臓と他臓器の臓器間コミュニケーション
研究目的
不整脈のなかでも、心房細動などは多くの全身性合併症を引き起こします。そのメカニズムはまだ完全に解明されておりませんが、脈の不規則性だけではない何かが存在すると考えられます。我々は、細胞外核酸・細胞外小胞に着目して、心筋細胞と他の細胞・心臓と他の臓器の間のコミュニケーションを中心に検討しています。
研究内容
当研究室では本学難治疾患研究所生体情報薬理学分野との共同研究で、心房筋細胞に機械的進展刺激を与えると心筋細胞がアデノシン三リン酸(ATP)を一過性に放出することを明らかにしました。アポトーシスを起こす細胞が、マクロファージを呼び寄せて自らを処理してもらうための”find-me signal”として、細胞外にATPを放出することが知られていますが、心筋細胞は機械的刺激によってATPを放出してマクロファージの遊走を惹起していました。高血圧や心不全などによって心房に機械的な負荷がかかった場合、細胞外ATPが原因となって心房の炎症が始まり、これが心房細動を起こす契機になると考えられました。ATPの放出経路は、ギャップ結合関連チャネルの一つである、Pannexin-2であることも明らかになりました(Oishi S, et al.)。
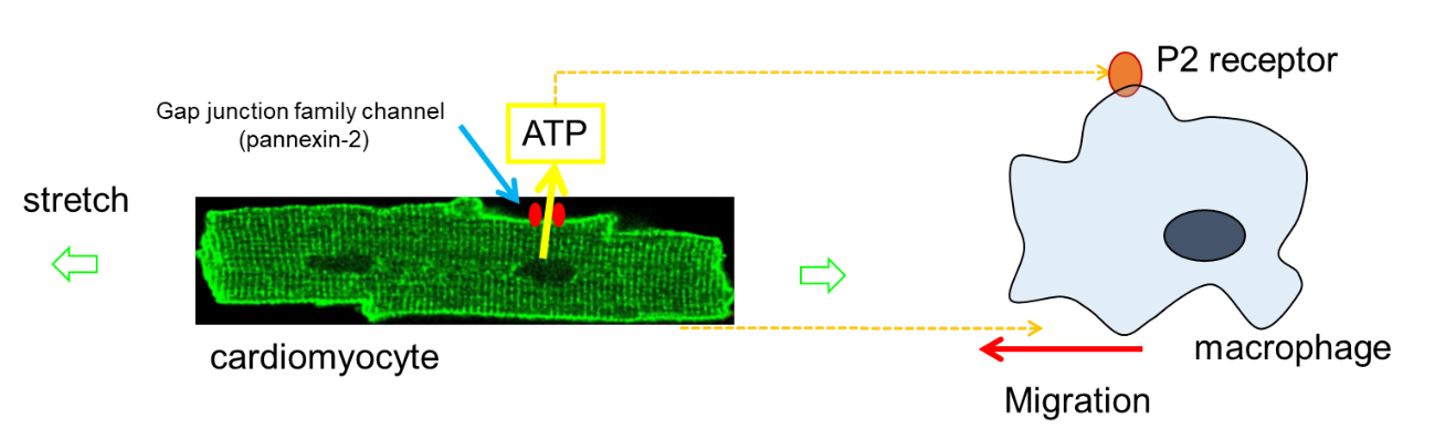
図:心筋細胞への機械的伸展刺激は、細胞外ATPを介してマクロファージを遊走させる。
また、我々は、高脂肪食負荷マウスにおいてマイクロRNA(miR)の発現を評価し、心房内でmiR-27bが増加し、それがCx40の発現抑制を介して心房性不整脈を引き起こすことを明らかにしました(不整脈1)。マイクロRNAは、exosomeという細胞外小胞に含まれた状態や、Ago-2などのタンパクに結合した状態などで安定的に血中を循環しているので、末梢血の採血によってマイクロRNAを定量することが可能です。
そこで我々は、発作性・持続性の心房細動症例および若年・高齢健常者の末梢血よりマイクロRNAを定量しました。マイクロRNAは数多く存在することが知られており、ヒトでも数千種類のmiRが確認されています。我々は主要な種類のマイクロRNAの定量を行い、さらに血中のマイクロRNAが心房の変化を反映しているかはわからないため、不整脈1研究で用いたマウスモデルを用いて、心房内のマイクロRNAの発現変化も網羅的に解析し、両者で共通するバイオマーカー候補のマイクロRNAを探索し、最終的に4つのバイオマーカー候補マイクロRNAを同定しました。これらのマイクロRNAを用いた心房細動の予測は、感度76%、特異度80%という結果を示しました(Natsume Y, et al. Circ J 2018)。血中マイクロRNAを定量することで、心房細動の発症予測や早期検出へ役立てることが期待されます。
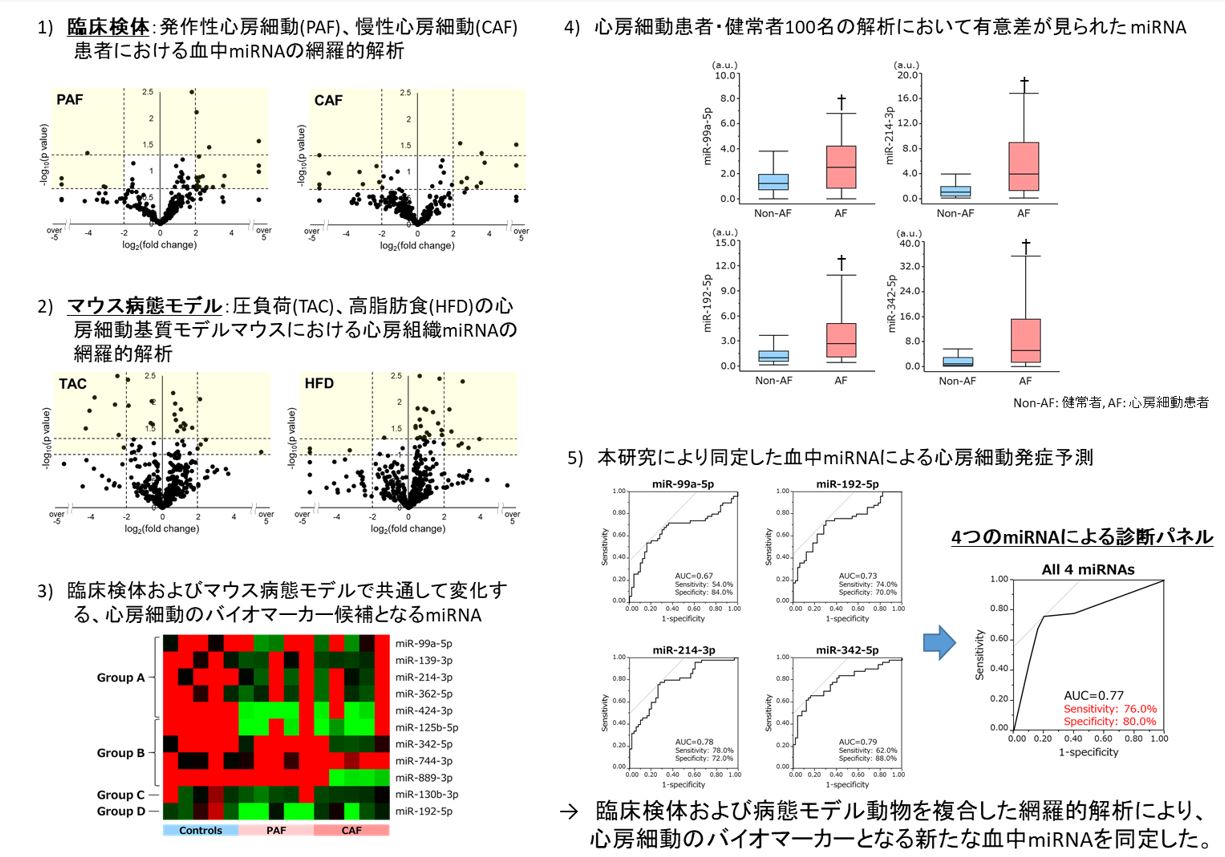
図: 心房細動のバイオマーカーとなる血中miRNAの同定(Natsume Y, et al. Circ J 2018より引用)。
さらに我々は、心房細動と炎症の関連について、細胞外DNAの関与に着目して検討しました。心房細動では血清CRPが上昇し、全身の微少炎症が生じることはよく知られていますが、そのメカニズムは解明されていませんでした。本研究では、細胞ストレスや細胞死に応じて細胞外へ遊離し血管内を循環するセルフリーDNAに着目し、血漿中セルフリーDNAレベルと心房細動の病態との関連、そして心筋細胞から放出されたセルフリーDNAが心房細動に付随する全身性炎症反応の原因となりうるかを検討しました(Yamazoe M, et al. Sci Rep 2021) 。
心房細動患者群(発作性心房細動患者、持続性心房細動患者)、非心房細動患者群(若年健常者、心房細動患者群と年齢をマッチさせた非心房細動高齢者)からそれぞれ末梢血を採取し、セルフリーDNAを抽出し定量したところ、心房細動群では非心房細動高齢者群よりもセルフリーDNAレベルが高値であることが分かりました(図3)。
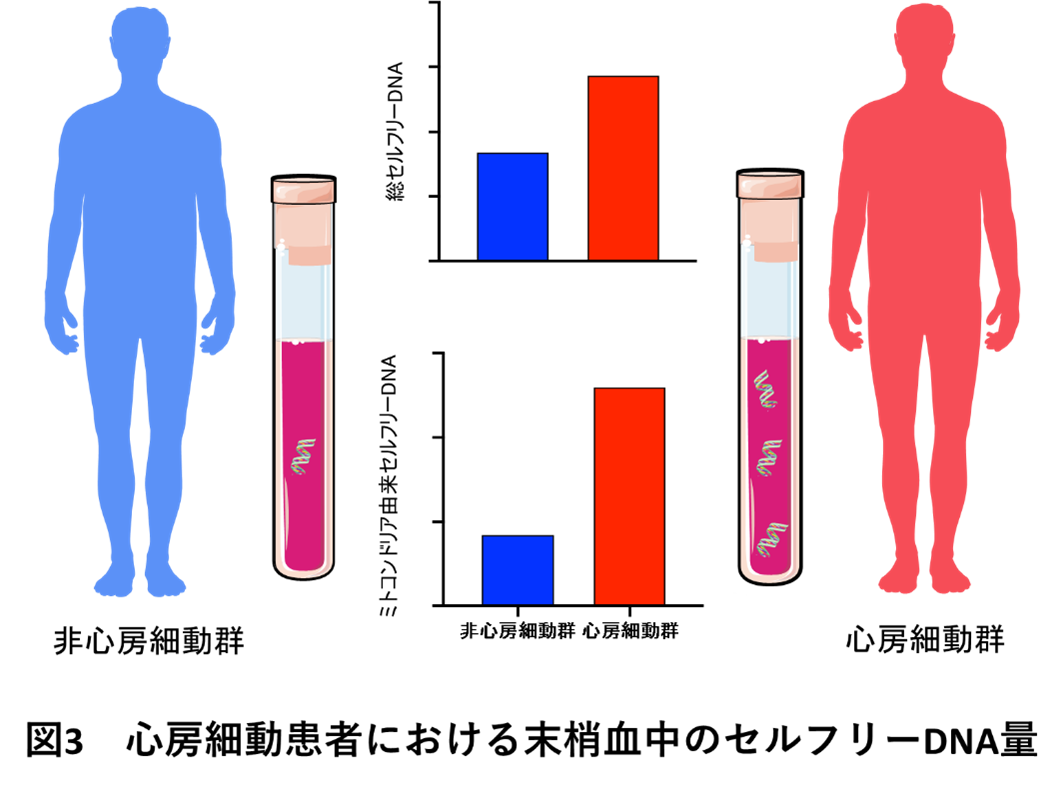
ヒトの細胞において、DNAは核の中に存在しますが、ミトコンドリアはもともと別の生物であったものが細胞内に取り込まれたという由来から、ミトコンドリア内には独自のDNAが存在します。そのため、セルフリーDNAもそれぞれ核由来セルフリーDNA、ミトコンドリア由来セルフリーDNAに分類することができます。我々の検討では、心房細動患者では特にミトコンドリア由来セルフリーDNAレベルが高いことが明らかとなりました。続いて、マウスに心房細動を模した高頻度ペーシング刺激を施したところ、臨床での検討と同様に血中のセルフリーDNAが上昇し、とくにミトコンドリア由来セルフリーDNAが増加していました。さらにマウス培養心筋細胞を用いた実験でも、高頻度ペーシング刺激によりセルフリーDNAが放出されたことから、高頻度興奮下にセルフリーDNAを放出するのは心筋細胞そのものであることが分かりました。
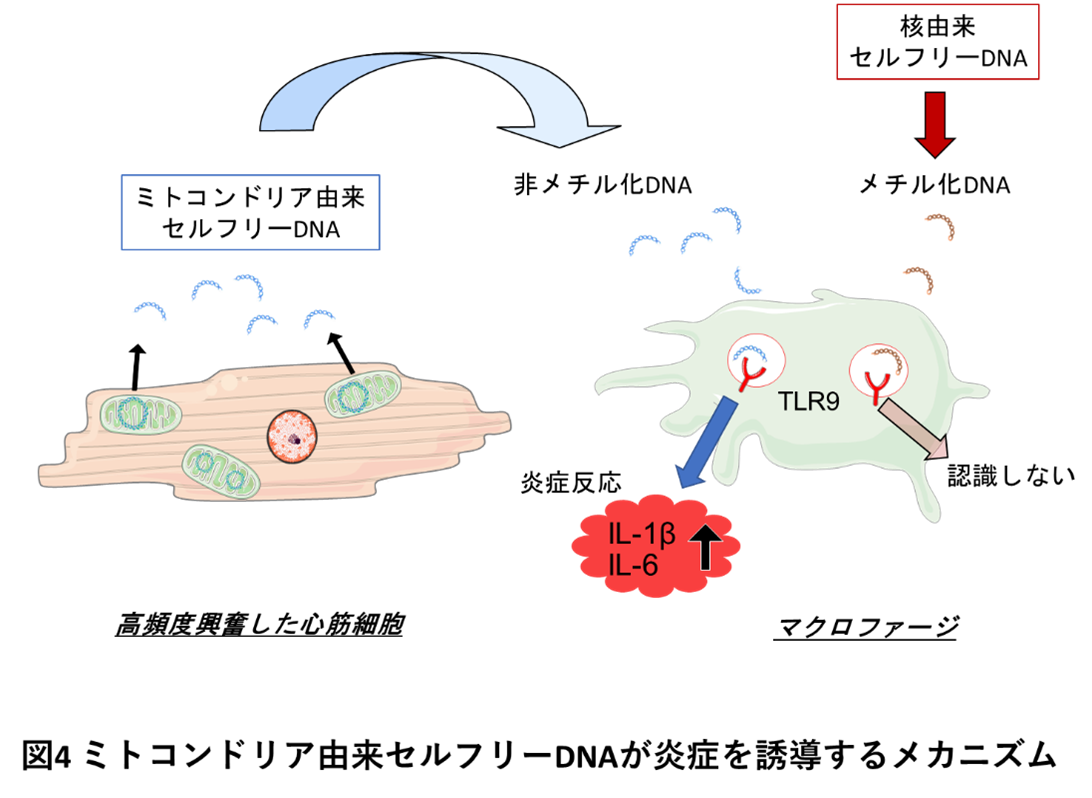
さらに、セルフリーDNAと炎症の関連を評価するために、高頻度興奮により心筋細胞から放出されたセルフリーDNAをマウスマクロファージ培養細胞に添加したところ、炎症性サイトカインであるインターロイキン1β(IL-1β)、インターロイキン6(IL-6)の発現上昇が見られました。この炎症誘導は、主にミトコンドリア由来セルフリーDNA添加によって生じました。核のDNAとミトコンドリアのDNAは、DNAのメチル化の程度が異なり、核DNAの大半はCpG領域がメチル化されていますが、ミトコンドリアDNAではメチル化CpGは全体の1%以下でした。マクロファージは、セルフリーDNAを取り込み、Toll-like receptor 9 (TLR9) を介して非メチル化DNAを認識して炎症反応を生じていました(図4)。
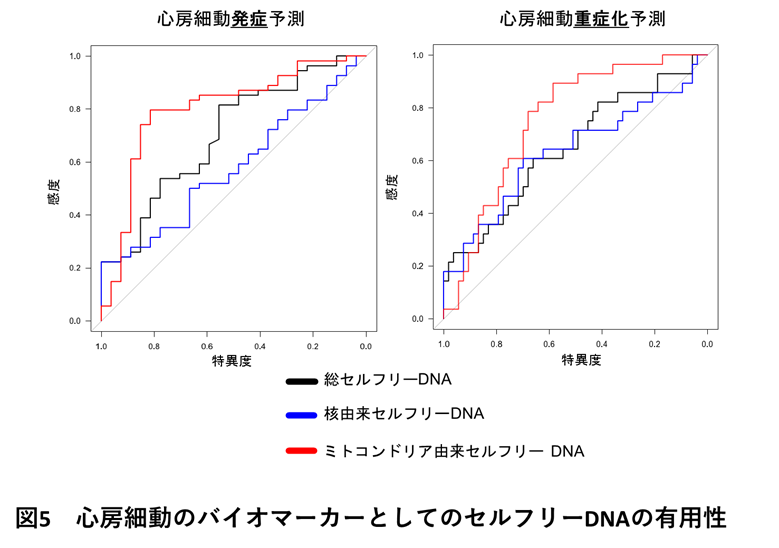
ヒトの末梢血における総セルフリーDNA、核由来セルフリーDNA、ミトコンドリア由来セルフリーDNAが、心房細動発症予測、ならびに心房細動が発作性から持続性への進展の予測能を評価したところ、ミトコンドリア由来セルフリーDNAが心房細動の発症、進展に良好な識別能を示すことが明らかとなりました(図5)。
本研究成果により、セルフリーDNA、特にミトコンドリア由来セルフリーDNAの心房細動発症、重症化の予測マーカーとしての応用が期待できます。中でも発作性心房細動は文字通り発作時でなければ診断が困難であるため、予測マーカーとしての応用は心房細動の早期発見、早期介入への橋渡しとなる可能性があります。さらに、セルフリーDNAを起点とした炎症反応経路を標的とすることで、心房細動合併症に対する新規治療法開発の糸口となることが期待されます。
・主な業績
-
Oishi S, Sasano T, Tateishi, Y, Tamura N, Isobe M, Furukawa T. Stretch of atrial myocytes stimulates recruitment of macrophages via ATP released through gap-junction channels. J Pharmacol Sci 2012; 120: 296-304.
-
Natsume Y, Oaku K, Takahashi K, Nakamura W, Oono A, Hamada S, Yamazoe M, Ihara K, Sasaki T, Goya M, Hirao K, Furukawa T, Sasano T. Combined Analysis of Human and Experimental Murine Samples Identified Novel Circulating MicroRNAs as Biomarkers for Atrial Fibrillation. Circ J 2018; 82: 965-973.
-
Yamazoe M, Sasano T, Ihara K, Takahashi K, Nakamura W, Takahashi N, Komuro H, Hamada S, Furukawa T. Sparsely methylated mitochondrial cell free DNA released from cardiomyocytes contributes to systemic inflammatory response accompanied by atrial fibrillation. Sci Rep 2021; 11: 5837.
文:山添正博 / 井原健介 / 笹野哲郎






