- HOME
- 基礎・トランスレーショナル研究 不整脈1
基礎・トランスレーショナル研究
不整脈1│不整脈2│血管炎│心不全│血液凝固│その他│循環生理解析グループ
臨床研究
動物モデルを用いた不整脈の分子機序解明研究
研究目的
心房細動をはじめとした不整脈疾患の分子機序を解明することにより、新たな治療標的分子を発見し、カテーテルアブレーションに代わる新規治療開発を目指します。
研究内容
当研究室では本学難治疾患研究所生体情報薬理学分野と共同研究を行い、近年開発されたゲノム編集技術であるCRISPR/Cas9を応用し、不整脈疾患患者で同定された遺伝子変異を導入した遺伝子改変マウスの作成や、手術介入による心筋梗塞モデルや大動脈縮窄術による心不全モデル作成、薬物負荷、高脂肪食負荷などを用いて様々な不整脈疾患の病態形成に寄与する分子メカニズムの解析を行っています。
RBM20遺伝子はスプライシング制御因子をコードし拡張型心筋症(DCM)の原因遺伝子として知られています。RBM20変異によるDCMは、他の遺伝子変異によるDCMと比較してより重症であり、心室性不整脈や心房細動といった不整脈を合併しやすいことが知られていました。近年、DCM症例で見つかるRBM20遺伝子の変異はRSRSP配列と呼ばれるRBM20タンパク質内のごく一部の領域に集中しており、このRSRSP配列の遺伝子変異によりRBM20の核移行能が障害されることが分かってきました。そこで、実際のDCM症例で発見されたRBM20のRSRSP配列内の1塩基置換変異Rbm20S637Aマウス作製し検討を行ったところ、Rbm20S637AマウスはRbm20 KOマウスと同様にスプライシング機能が完全に欠失していましたが、Rbm20S637Aマウスのみが、DCMの心表現型を呈し、心室性不整脈・心房細動の合併をみとめました。細胞内でのRBM20タンパク質の分布を検討すると、野生型マウスではRBM20が細胞核の中に限局するのに対し、Rbm20S637Aマウスで変異型RBM20タンパク質は細胞核中には存在せず、細胞質に蓄積して顆粒状構造を形成していました。一方、Rbm20 KOマウスでは細胞核内にも細胞質にもRBM20タンパク質は認められませんでした。
スプライシング制御機能が同様に完全に欠損しているにも関わらず、Rbm20S637Aマウスのみで重症DCMを生じることは、RBM20遺伝子変異による重症DCMは従来考えられてきたスプライシング異常だけでは説明がつかず、RBM20タンパク質が正常と異なり細胞質に蓄積して新たな機能を獲得することがDCM重症化、心房細動をはじめとした不整脈をもたらすことが本研究により明らかになりました(Ihara et.al. Sci Rep.2020)。

図:Rbm20遺伝子変異によるDCM重症化のメカニズム (Ihara et.al. Sci Rep.2020より一部改変して引用)
心房細動の発症には後天的素因と遺伝的素因の両者が関与すると考えられています。遺伝的素因の検索として我々はエクソームワイド関連解析を行い、心房細動に関連するレアバリアントとしてTKS5遺伝子の変異を発見しました。この遺伝子変異はTKS5タンパク質の1アミノ酸置換(L396R)を生じますが、この変異がどのように心房細動発症に関与するのかを検討するため、培養細胞を用いて機能評価を行ったところ、変異型TKS5はマクロファージの遊走能を亢進させることが分かりました。また、変異型TKS5を導入したマクロファージでは炎症性マーカーの発現が亢進していました。これらの結果はTKS5(L396R)変異が、心房炎症の亢進を介して心房細動の発症に寄与していることを強く示唆するものと考えられました(Yang et.al. Circ J. 2020) 。
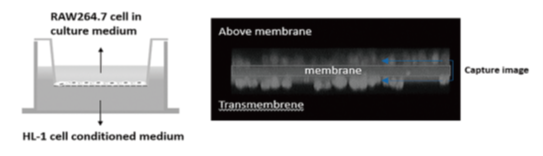
図:マクロファージ培養細胞を用いた遊走能評価 (Yang et.al. Circ J. 2020より引用)

図:Irx3欠損マウスで見られた心室頻拍
(Koizumi et.al. Eur Heart J. 2016 より引用)
特発性心室細動は一見健常である心臓における心臓性突然死の重要な原因です。特発性心室細動の発生においてHis-Purkinje系が重要であることは示唆されていましたが、そのメカニズムに関しては不明でした。私たちはHis-Purkinje系に特異的に発現する転写因子IRX3に注目し、Irx3欠損マウスにおいて運動中に心室性不整脈が生じること、さらにIrx3がCx40やScn5aなどのギャップ結合タンパク・イオンチャネルの遺伝子発現に重要な役割を果たしていることを明らかにしました。実際の心室細動患者の遺伝子解析を行ったところ、IRX3の新規遺伝子変異を見出し、IRX3異常がHis-Purkinje系での標的遺伝子の発現異常を介して特発性心室細動を呈する可能性を示しました (Koizumi et.al. Eur Heart J. 2016) 。

図:Nos1ap欠損マウスの潅流心を用いた光学マッピングによる活動電位波形
(Sugiyama et.al. Int Heart J 2016 より引用)
NOS1APはゲノム関連解析で同定されたQT延長や心臓突然死の関連遺伝子ですが、その遺伝子変異がどのように心臓突然死を生じているのかは不明でした。我々はNos1ap遺伝子欠損マウスにドキソルビシン投与で酸化ストレスを生じることにより、著明なQT延長と心室性不整脈の発生、突然死の増加を生じることを明らかにし、さらに抗酸化作用を持つNアセチルシステインの投与により、それらの変化を抑制することを示しました (Sugiyama et.al. Int Heart J 2016)。この成果はアジア太平洋不整脈不整脈学会においてYIA 1st prizeに表彰されました。
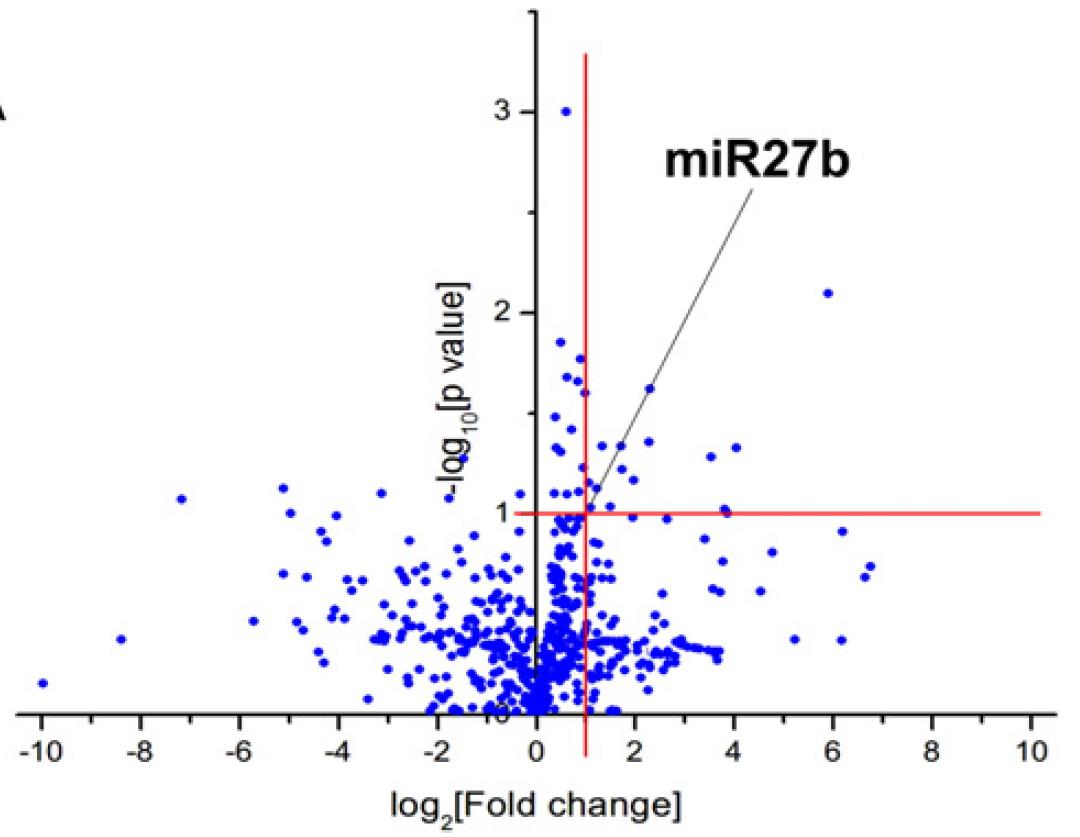
図:高脂肪食マウスの心房におけるマイクロRNAアレイ解析
(Takahashi et.al. J Mol Cell Cardiol.2016 より引用)
肥満や脂質異常症が心房細動発症のリスク因子であることは知られていますが、どのような分子メカニズムで発症に寄与しているかは十分にわかっていません。私たちはマウスに高脂肪食負荷を行い、高脂肪食マウスにおいて心臓電気生理学的検査・光学マッピングで心房性不整脈の誘発率が上昇すること、興奮伝導速度が低下することを明らかにし、それらの変化がマイクロRNA(miR-27b)の発現を介したCx40の遺伝子発現抑制によってもたらされていることを報告しました (Takahashi et.al. J Mol Cell Cardiol.2016)。
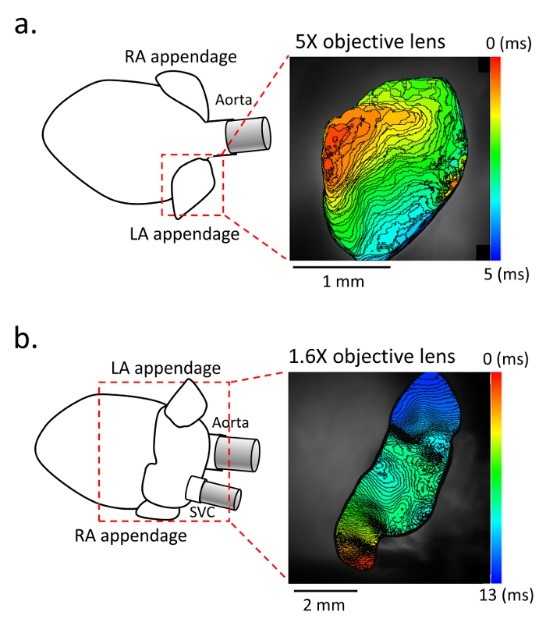
図:マウス潅流心の高解像度光学マッピング
(Ihara et.al. J Vis Exp. 2018 より引用。動画リンクはこちら。
またそれら以外にもゲノム関連解析などで同定された様々な心房細動関連遺伝子の遺伝子改変マウスを作成し、表現型解析をもとにそれぞれのマウスにおいて分子メカニズム解明研究を進めています。これらの表現型解析において重要な技術として光学マッピングがあります。当研究室では高時間解像度・高空間解像度を持つ光学マッピングシステムと臨床と同等の詳細な心臓電気生理学的検査を組み合わせた手法を確立し、心室性不整脈だけでなく、小さなマウス心房においても高精細に心房性不整脈を解析可能です (Ihara et.al. J Vis Exp. 2018)。さらに、本学難治疾患研究所エピジェネティクス分野との共同研究では新規に作成した心臓オルガノイドを評価するため本システムを活用し、その電気生理学的性質を詳細に検討・報告しました(Lee et.al. Nat Commun.2020)。
現在はそのマッピングシステムをさらに改良するため、東京大学医用精密工学研究室と解析システム開発の共同研究を行っています。
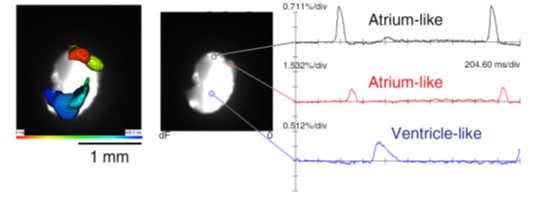
図:心臓オルガノイドの光学マッピング(Lee et.al. Nat commun.2020.より引用)
次世代シークエンス技術をはじめとした遺伝子解析技術や診療技術の急激な進歩とともに、不整脈疾患をはじめとして多くの循環器疾患で今まで分からなかった遺伝子異常が次々と明らかになってきています。それら遺伝子が病態形成に関わる分子メカニズムを解明していくために、動物モデルを用いたアプローチで研究を進めていきます。
・主な業績(代表7編)
-
Ihara K, Sasano T, Hiraoka Y, Togo-Ohno M, Soejima Y, Sawabe M, Tsuchiya M, Ogawa H, Furukawa T, Kuroyanagi H. A missense mutation in the RSRSP stretch of Rbm20 causes dilated cardiomyopathy and atrial fibrillation in mice. Sci Rep. 2020. 10: 17894. https://doi.org/10.1038/s41598-020-74800-8
-
Yang X, Sasano T, Ebana Y, Ihara K, Yamazoe M, Furukawa T. Functional role of L96R mutation of Tks5 identified by Exome-Wide Association Study in atrial firillation. Circ J. 2020;84(12):2148-2157.
-
Lee J, Sutani A, Kaneko R, Takeuchi J, Sasano T, Kohda T, Ihara K, Takahashi K, Yamazoe M, Morio T, Furukawa T, Ishino F. In vitro generation of functional murine heart organoids via FGF4 and extracellular matrix. Nat Commun. 2020. 3;11(1):4283.
-
Ihara K, Sugiyama K, Takahashi K, Yamazoe M, Sasano T, Furukawa T. Electrophysiological Assessment of Murine Atria with High-Resolution Optical Mapping. J Vis Exp. 2018 Feb 22;(132). doi: 10.3791/56478.
-
Koizumi A, Sasano T, Kimura W, Miyamoto Y, Aiba T, Ishikawa T, Nogami A, Fukamizu S, Sakurada H, Takahashi Y, Nakamura H, Ishikura T, Koseki H, Arimura T, Kimura A, Hirao K, Isobe M, Shimizu W, Miura N, Furukawa T. Genetic defects in a His-Purkinje system transcription factor, IRX3, cause lethal cardiac arrhythmias.Eur Heart J. 2016 May 7;37(18):1469-75.
-
Takahashi K, Sasano T, Sugiyama K, Kurokawa J, Tamura N, Soejima Y, Sawabe M, Isobe M, Furukawa T. High-fat diet increases vulnerability to atrial arrhythmia by conduction disturbance via miR-27b. J Mol Cell Cardiol. 2016 Jan;90:38-46.
-
Sugiyama K, Sasano T, Kurokawa J, Takahashi K, Okamura T, Kato N, Isobe M, Furukawa T. Oxidative Stress Induced Ventricular Arrhythmia and Impairment of Cardiac Function in Nos1ap Deleted Mice. Int Heart J. 2016 May 25;57(3):341-9.
文:井原健介/笹野哲郎






